揭示Ago蛋白相关NADase在细菌免疫中的激活机制
烟酰胺腺嘌呤二核苷酸(NAD+)是细胞周期中的核心代谢物,NAD+耗竭是存在于原核和真核生物中的免疫机制。近期,在一些细菌内发现短的原核Argonaute蛋白(Ago)可以与在同一操纵子中编码的含NADase结构域(TIR或SIR2)协作,通过识别靶标核酸来诱导NAD+耗竭继而抵抗移动遗传元件(如噬菌体和质粒)的入侵1,2。然而,这种NADase/Ago原核免疫系统的潜在分子机制仍然未知。
2023年6月13日,天津医科大学张恒团队与中国科学院武汉病毒所邓增钦团队和湖北大学李壮团队合作在Cell Research 杂志发表了题为“Structural insights into mechanisms of Argonaute protein-associated NADase activation in bacterial immunity”的研究论文。该研究解析了来自两个不同系统(TIR / Ago和SIR2 / Ago)的NADase / Ago复合物不同组装状态下的冷冻电镜结构,发现TIR / Ago系统通过识别结合target DNA(tDNA)触发TIR/Ago复合物的高阶寡聚化,而SIR2/Ago复合物的异源二聚体状态在tDNA结合后不会改变。并通过体外生化实验阐明了两个系统如何识别核酸激活NADase活性的分子机制。这项工作揭示了Ago蛋白相关NADase在原核免疫反应中的多样性和相似性。

为了研究TIR-APAZ和Ago蛋白之间的相互作用模式,作者首先从Maribacter polysiphoniae(以下简称TIR / Ago复合物,也称为SPARTA)中共纯化二元复合物,并在存在guide RNA(gRNA)的情况下测定其冷冻电镜结构。通过体外NAD降解实验证明,apo TIR/Ago和RNP复合物中的TIR结构域在催化上无活性,但tDNA结合可以有效地激活NADase活性。为了阐明激活TIR/Ago复合物的分子基础,作者重建了tDNA结合的四元复合物,并以2.95 Å的分辨率测定了其冷冻电镜结构。TIR/Ago-gRNA-tDNA复合物显示出具有四个TIR/Ago异二聚体拷贝的“蝴蝶形”结构,与生化结果一致,当RNP识别结合tDNA后可以诱导TIR/Ago 的高阶寡聚化。四个TIR/Ago复合物通过TIR结构域的四聚化形成两个翅膀区(wing region)。两个Ago分子与APAZ结构域结合成对称的头对头二聚体,形成蝴蝶的翅膀。两个翅膀及其各自的TIR在结构上是相同的,虽然它们以不对称的方式组成。然而,同一翅膀中的两个TIR/Ago单元采用不同的构象,分别称为 A/A' 和 B/B' 单位(图1上)。对于另一种来自Geobacter sulfurreducens物种中的NADase/Ago系统(SIR2/Ago),作者以3.0 Å的分辨率解析了SIR2/Ago-gRNA-tDNA四元复合物的冷冻电镜结构。与TIR/Ago系统类似,tDNA结合可以触发SIR2/Ago系统的NADase活性。但是SIR2/Ago复合物在gRNA-tDNA双链存在下不会组装成高阶低聚物,这与TIR/Ago复合物的高阶寡聚化相反。生化实验和结构比对证明,SIR2/Ago系统通过识别结合tDNA使复合物获得更开放的构象,继而使SIR2结构域游离于APAZ/Ago结构域并获得NADase活性(图1下)。
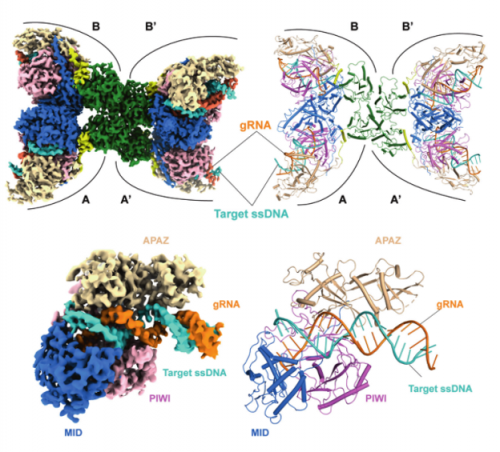
图1 上:TIR/Ago-gRNA-tDNA四元复合物的四聚状态 下:SIR2/Ago-gRNA-tDNA四元复合物研究两种系统NADase活性的激活机制,作者首先通过比较复合物激活和未激活状态的结构变化,发现在靶ssDNA结合后,均有一段loop从gRNA–tDNA双链转移,被重新拉伸并折叠成β链,表明该环可以作为检测gRNA–tDNA双链形成的传感器。该回路被称为“传感器回路”。接下来,作者通过体外ɛ-NAD+降解实验和蛋白聚集实验确定了在不同长度下ssDNA存在情况下NADase被激活的情况,发现两种系统至少需要15nt长度的ssDNA才可以顺利激活,该长度与结构上传感器回路阻挡的空间位置相符。

图2 左:TIR/Ago复合物对不同长度ssDNA的体外ɛ-NAD+降解实验 中:TIR/Ago复合物在不同长度ssDNA存在下聚集情况的Native PAGE 右:SIR2/Ago复合物对不同长度ssDNA的体外ɛ-NAD+降解实验对于tDNA的识别,两种系统都利用Ago蛋白PIWI结构域中的保守传感器回路来检测,从而启动TIR或SIR2结构域中NADase活性所需的构象变化。但是TIR结构域需要寡聚以形成TIR/Ago系统中的活性口袋,而SIR2结构域通过识别tDNA结合增加其灵活性来激活。
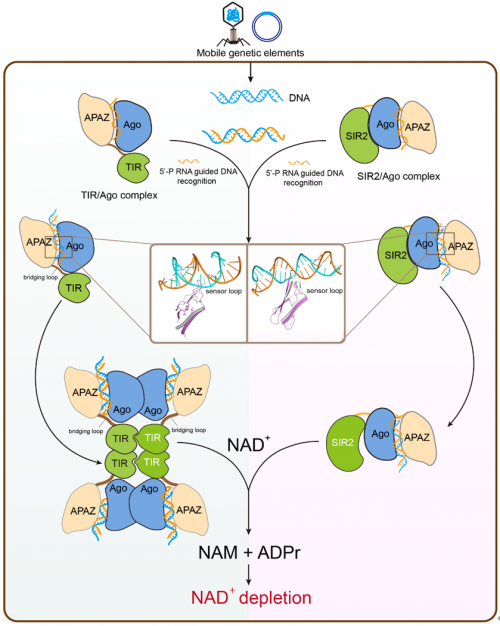
图3 TIR/Ago和SIR2/Ago系统的NADase激活机制示意图该研究通过解析不同状态下TIR / Ago和SIR2 / Ago复合物的多种冷冻电镜结构,结合生化突变实验,揭示了短原核Ago/NADase系统在细菌免疫反应中的多样性和保守性特征。这项工作提供了对短原核Ago/NADase系统的第一个结构理解,也为细菌免疫中Ago和NAD+耗竭机制的进一步研究奠定了基础。原文链接:https://www.nature.com/articles/s41422-023-00839-7
财经号声明: 本文由入驻中金在线财经号平台的作者撰写,观点仅代表作者本人,不代表中金在线立场。仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。同时提醒网友提高风险意识,请勿私下汇款给自媒体作者,避免造成金钱损失,风险自负。如有文章和图片作品版权及其他问题,请联系本站。


