揭示T细胞急性淋巴细胞白血病的潜在发病新机理
T细胞急性淋巴细胞白血病(T-ALL)是一种预后不良的侵袭性血液恶性肿瘤,迫切需要新的治疗靶点和治疗策略。N6 -甲基腺苷(m6A )是一种重要的甲基化修饰,通过调节关键基因的mRNA影响白血病的发病机制。干扰素调节因子8 (IRF8)是血液谱系定型的关键转录因子,但其在T-ALL中的作用尚不清楚。
2022年12月7日,山东大学纪春岩及叶静静共同通讯在Advanced Science在线发表题为“Silencing of IRF8 Mediated by m6A Modification Promotes the Progression of T-Cell Acute Lymphoblastic Leukemia”的研究论文,该研究证明IRF8可以抑制T-ALL进展,T-ALL患者中IRF8的表达异常沉默,IRF8基因敲除显著加速Notch1诱导的T-ALL在体内的进展。IRF8的过表达通过抑制磷脂酰肌醇3-激酶/AKT信号通路来抑制T-ALL细胞的增殖和侵袭。
FTO是一种m6A去甲基化酶,负责直接结合IRF8信使RNA(mRNA)3’非翻译区的m6A位点,并通过m6A修饰诱导mRNA降解。靶向FTO-IRF8轴被用作概念治疗的证明:恢复IRF8表达、抑制FTO的脱甲基酶活性显著缓解了白血病细胞的增殖并延长了T-ALL小鼠的存活。总之,该研究从表转录组学的角度阐明了T-ALL的发病机制,并为T-ALL的遗传机制和靶向治疗提供了新见解。

T细胞急性淋巴细胞白血病(T-ALL)是一种侵袭性血液病,起源于恶性淋巴祖细胞。标准化疗情况下仅有40-50%的成年T-ALL患者能存活5年以上。更糟糕的是,大约40%的成年T-ALL患者出现复发,导致长期总生存率低于7%。新的研究揭示了基因改变在促进T-ALL的启动和进展中的关键作用,如notch 受体1 (NOTCH1)基因的突变异常激活了磷脂酰肌醇3-激酶(PI3K)/AKT信号通路和表观遗传改变。然而,靶向治疗(如NOTCH1和AKT抑制剂)目前尚不适用于T-ALL患者,普通的DNA去甲基化剂(如地西他滨)对T-ALL的治疗效果有限。因此,迫切需要开发有效的靶向疗法,深入研究T-ALL病理生物学背后的遗传机制。干扰素调节因子8 (IRF8)是一种重要的血液谱系定型的重要转录因子。IRF8对于维持骨髓细胞发育不可或缺,其表达受损被认为是髓性白血病的致病因素。最近,IRF8在淋巴细胞发育和功能中的关键作用已被揭示。IRF8缺陷阻断了CD8+ T细胞向效应细胞的转化。此外,IRF8可作为辅助性T细胞17型细胞分化的负调节因子。然而,IRF8在淋巴恶性肿瘤发病机制中的作用和机理仍不清楚。
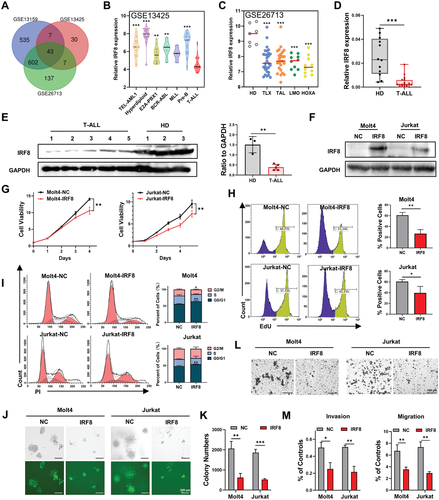
图1 IRF8表达沉默是T-ALL增殖和侵袭的主要原因(摘自Advanced Science )N6 -甲基腺苷(m6A)修饰是真核信使RNA(mRNA)中最常见的表观转录组修饰。最近的研究表明,m6A修饰是一个动态且可逆的过程,涉及多种生物过程。在RRACH的共识基序处进行m6A修饰(R = G或A; H = A、C 或 U)由 m6A“writer”“eraser”和“reader”蛋白的平衡配位调节。”Writers“是指由甲基转移酶样3(METTL3)催化亚基以及其他辅助亚基(如甲基转移酶14(METTL14)、肾母细胞瘤1关联蛋白(WTAP)和RNA结合基序蛋白15(RBM15))形成的甲基转移酶复合物,并催化m6A构型。相反,“eraser”是去除m6A的去甲基化酶,如脂肪量和肥胖相关蛋白(FTO)和alkB同系物5(ALKBH5)。除了改变RNA结构外,m6A还可以被“reader”识别和结合,如YTH N6-甲基腺苷RNA结合蛋白(YTHDFs)和胰岛素生长因子2 mRNA结合蛋白(IGF2BPs),以控制翻译、稳定、拼接、折叠和运输等RNA代谢。越来越多的证据表明,“writer”“eraser”和“reader”之间的不平衡在白血病的发生和发展中起着重要的作用。在急性髓系白血病(AML)中,METTL3增加m6A丰度可增强AML的细胞生长并抑制髓系分化。同时,FTO参与AML的延迟分化并诱导细胞凋亡。m6A调节剂的重要性和可逆性使其成为小分子抑制剂的潜在治疗靶点。如FTO的高选择性和强效催化抑制剂(FB23-2)表现出对AML发展的显著抑制,并延长了AML受体在体内的存活。然而,几乎没有关于m6A在T-ALL中的作用的研究。
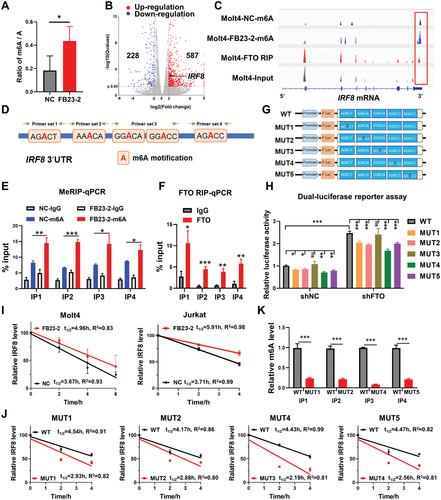
图2 FTO通过m6A剂量依赖性机制抑制IRF8(摘自Advanced Science )该研究证明了IRF8在TALL中被沉默,IRF8的强制表达有效抑制了T-ALL细胞的增殖和侵袭,IRF8的敲除通过激活PI3K/AKT信号通路加速了Notch1诱导的T-ALL的发展。T-ALL中FTO升高可逆地减少了IRF8的m6A修饰,从而通过改变mRNA的稳定性降低了IRF8的表达。此外,FB23-2对FTO的抑制有效地恢复了IRF8的表达,并延长了T-ALL小鼠的生存期。总之,该研究结果揭示了IRF8在T-ALL中的抑制作用,并提供了一种靶向IRF8 mRNA的表观转录组修饰酶的新途径,作为一种有希望的替代策略来治疗T-ALL。
参考消息:https://onlinelibrary.wiley.com/doi/10.1002/advs.202201724
财经号声明: 本文由入驻中金在线财经号平台的作者撰写,观点仅代表作者本人,不代表中金在线立场。仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。同时提醒网友提高风险意识,请勿私下汇款给自媒体作者,避免造成金钱损失,风险自负。如有文章和图片作品版权及其他问题,请联系本站。客服咨询电话:059163307968、059163307969。


