产品爆发前夜,减肥药真龙,目前能否挥杆?

导语:本文全长10000字,花了两周时间写完,建议先点“在看”、收藏,闲暇时泡上一杯好茶慢品。
正文:
今天跟大家聊聊信达生物。
相信关注创新药的朋友对这家公司一定不会陌生,我们也丝毫不否认,我们的研究太滞后了,应该尽早关注这家公司。
我对信达开始感兴趣,主要是因为它是真正的国内减肥龙头,其GLP-1R/GCGR双靶激动剂目前已经进入到三期临床,并且从数据上已经展现出比较性优势。
但是,近段时间由于国内对减肥概念的炒作,信达的股价也呈现出了不小的反弹,所以,我们也不期望这次研究能够给我带来一个可以挥杆的标的,主要还是继续以学习的心态,持续对国内创新药企的发展动态,管线情况有一个不断更新的认知。
通过这篇文章,我们希望解决几个问题:
1)对信达的核心管线情况做一个全面的了解;
2)信达的比较竞争优势在哪,能否持续?
3)目前信达是否适合投资,投资策略是怎样的?
闲话不多说,开始我们的深度分析。
01公司&行业分析
公司介绍
信达生物于2011年由俞德超博士创立,并已打造符合全球品质标准的全面集成生物制药平台,集研发、临床开发、CMC及商业化能力于一体。
公司已建立起一条丰富的产品管线,涵盖一系列创新治疗靶点及药物形式(包括单克隆抗体、多特异性抗体、免疫细胞因子、融合蛋白、T细胞接合器、抗体偶联药物、细胞治疗及小分子药等),覆盖肿瘤、心血管及代谢、免疫及眼科等多个重大疾病领域,产品管线具有作为单药或联合疗法的巨大临床及商业化潜力,以满足广阔的医疗需求。
管线介绍
肿瘤领域已拥有丰富的商业化品种及临床后期管线,重点加速推进单/双抗和ADC前沿创新产品。目前已有8款产品获批上市,3款处于关键临床阶段,10多款处于临床开发阶段。
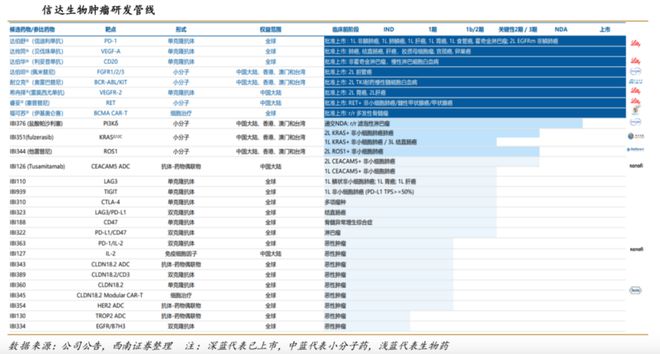
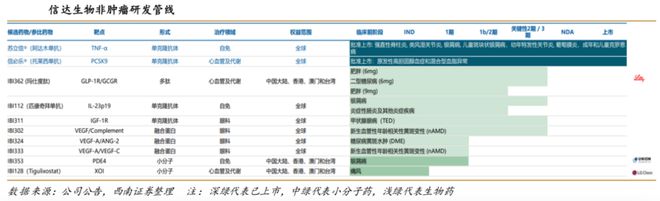
非肿瘤管线深度布局三大慢性病领域,重点加速高潜管线开发,包括心血管及代谢疾病(PCSK9、GLP-1/GCGR、XOI),自身免疫疾病(IL-23p19、CD40L、OX40L),眼科疾病(IGF-1R、VEGF类双抗)等。目前拥有2款商业化产品,4款处于关键临床阶段,4款处于临床开发阶段。
重点产品、管线介绍
癌症领域
信迪利单抗
达伯舒(信迪利单抗注射液)是信达生物制药和礼来制药在中国共同合作研发的具有国际品质的创新生物药,于2018年12月27日正式获得NMPA批准。
国内PD-1单抗竞争激烈。国内最先上市的国产PD-1单抗特瑞普利单抗、信迪利单抗、
卡瑞利珠单抗、替雷利珠单抗已分别获批6、7、9、11个适应症。
目前信迪利单抗销售额大概处于第二第三的位置,第一名是百济神州,毫无疑问百济的适应症拓展和商业化能力是创新药企里是一流水平,信达也基本能够进入到第一梯队里。
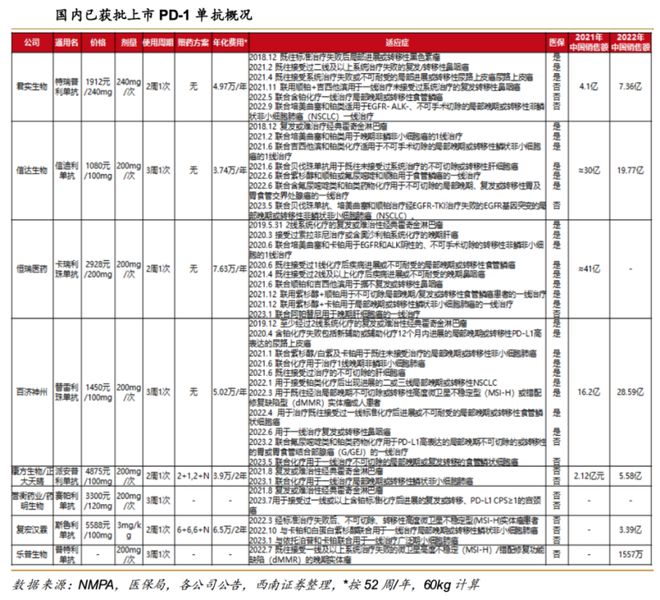
达伯舒®(信迪利单抗注射液)是首个且唯一纳入NRDL胃癌治疗(2022年7月份获批)的国产PD-1抑制剂,也是唯一将五大高发瘤种(肝癌、非鳞状非小细胞肺癌、鳞状非小细胞肺癌、食管癌、胃癌)一线治疗纳入NRDL(2023年一月纳入医保目录)的PD-1抑制剂,所以,信达PD-1后续的增长潜力还是非常巨大的。
奥雷巴替尼
奥雷巴替尼是亚盛医药开发的第三代BCR-ABL抑制剂。它对BCR-ABL以及包括T315I突变在内的多种BCR-ABL突变体有突出效果,可用于治疗对第一代、第二代TKI耐药的CML患者。
2021年7月,亚盛医药与信达生物达成在中国市场就奥雷巴替尼在肿瘤领域共同开发和共同商业化推广的战略合作。2021年11月25日,奥雷巴替尼获NMPA批准上市,用于治疗任何酪氨酸激酶抑制剂(TKI)耐药,并采用经充分验证的检测方法诊断为伴有T315I突变的CML慢性期(CP)或加速期(AP)的成年患者。
根据亚盛医药2022年财报披露,从奥雷巴替尼获批上市至2022年12月31日,该产品实现累计含税销售额为人民币1.82亿元(经审计含增值税金额)。
2023上半年,奥雷巴替尼(商品名:耐力克)在今年1月纳入了新版国家医保药品目录,上半年实现收入1.08亿元,同比增长37%。
伊基奥仑赛注射液
福可苏®(伊基奥仑赛注射液)是信达与驯鹿生物共同研发,中国首个获批的全人源BCMACAR-T细胞疗法。2023年6月,福可苏®(伊基奥仑赛注射液)获NMPA批准用于治疗复发/难治性多发性骨髓瘤(r/rMM)成人患者,既往接受过至少三种疗法(包括蛋白酶体抑制剂和免疫调节剂)。
其以慢病毒为基因载体转染自体T细胞,CAR包含全人源scFv、CD8a铰链和跨膜、4-1BB共刺激和CD3ζ激活结构域。基于严格的筛选,通过全面的体内外功能评价,具有强有力和快速的疗效,并有突出的体内持久存续性。
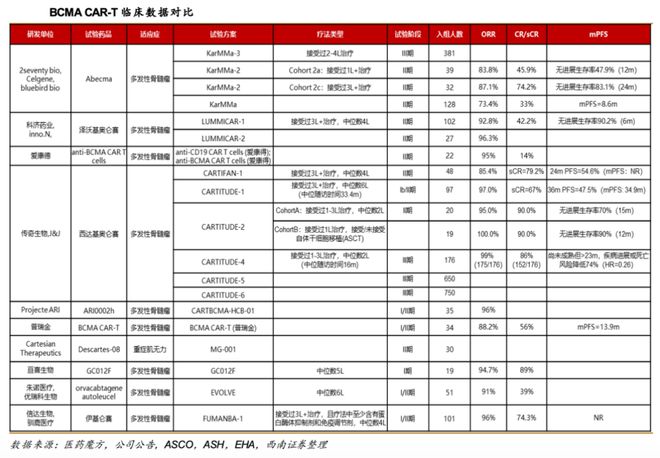
从临床数据来看,信达生物的伊基奥仑赛注射液还是具备一定程度的比较性优势的。
目前CAR-T细胞疗法国内价格普遍非常昂贵,福可苏的定价为116.6万元/支。公开资料显示,此前国内上市的倍诺达和奕凯达,定价分别为129万和120万。这类药品目前基本不进入不了医保目录,所以推广和放量情况相对会慢一些。
IBI363(PD-1/IL-2)双抗
潜在强效的双特异性融合蛋白。
IBI363是由信达生物自主研发的潜在同类首创新药(First-in-Class),有效成分为PD-1/IL-2双特异性抗体融合蛋白,通过同时阻断PD-1/PD-L1通路和激活IL-2通路,刺激T细胞活化、增殖,从而达到持续杀伤肿瘤细胞控制肿瘤生长的目的。目前IBI363在中国和澳大利亚进行临床I期研究(NCT05460767,NCT05290597),以评估IBI363在晚期实体瘤或淋巴瘤受试者中安全性、耐受性和初步有效性,并确定II期推荐剂量(RP2D)。
公司IBI363的IL-2臂采用α-biased设计,在提高疗效的同时降低IL-2相关毒性,而PD-1结合臂可以实现对PD-1的阻断和IL-2的选择性递送。因此,IBI363具有同时阻断PD-1/PD-L1通路和激活IL-2通路两项功能,可以更精确和有效地实现对肿瘤特异性T细胞。
IBI-343(CLDN18.2ADC)
IBI343是重组人源抗CLDN18.2ADC,与表达CLDN18.2的肿瘤细胞结合后,可发生CLDN18.2依赖性ADC内化,并释放毒素药物引起DNA损伤,导致肿瘤细胞凋亡。游离的毒素药物也可以通过质膜扩散到达并杀死相邻的肿瘤细胞,因此IBI343也具有旁观者效应。
IBI343在CLDN18.2低表达和高表达的荷瘤药理学模型中均展现出了良好抗肿瘤活性,同时在临床前模型中安全性特征良好,整体安全性可控。
目前,IBI343正于澳大利亚及中国同步开展1期临床实验,初步显示出同类最佳的潜力。
IBI126(CEACAM5ADC)
全球首创且唯一处于临床III期的抗CEACAM5ADC。
靶向癌胚抗原相关细胞粘附分子5(CEACAM5),一种在非小细胞肺癌、胃癌和其他癌
症中高度表达的细胞表面糖蛋白,其中CEACAM5高表达占肺癌25-30%,胃癌20-30%,
胰腺癌10-20%。Payload(DM4/Maytansinoid)属于抗微管蛋白,相比多西它赛强效100倍,在临床前研究中可诱导免疫原性细胞死亡。
目前,IBI126正在全球范围内开展2LNSCLC的3期研究(包括中国),以及1LNSCLC、
胃癌及其他实体肿瘤的全球2期研究。2023年,信达启动了一项中国2期临床研究,探索IBI126联合信迪利单抗联合或不联合化疗治疗CEACAM5阳性表达的1L非鳞状NSCLC。
非癌症领域
托莱西单抗
首个获批上市的中国原研PCSK9单抗。
高胆固醇血症是指血液中胆固醇含量过高,过多的胆固醇堆积在动脉壁上形成斑块,称为“动脉粥样硬化斑块”可能引起血压升高,器官缺血甚至是心脏病发作和脑卒中,这是高胆固醇血症最危险的后果。卫生部中日友好医院的杨文英教授公布的一项研究显示,我国≥20岁人群中,高胆固醇血症的患病率为9.0%,临界性高胆固醇血症的患病率为22.5%患者群体非常大。
2023年8月,信必乐®(托莱西单抗注射液)获NMPA批准,成为首个获批上市的中国原研PCSK9单抗,具有显著降低低密度脂蛋白胆固醇水平及延长给药间隔的优势。PCSK9主要由肝脏产生,与肝细胞表面的LDL受体(LDL-R)结合,使LDL-R降解,血浆LDLC水平升高。PCSK9抗体能干扰其与LDL-R的结合,使肝脏表达更多的LDL-R,降低血浆LDL-C水平,从而起到降血脂的功能。
玛仕度肽
全球首个进入临床III期的GLP-1R/GCGR双靶激动剂
玛仕度肽是信达生物与礼来公司共同开发的一种新药,双方于2019年8月签署了合作协议。
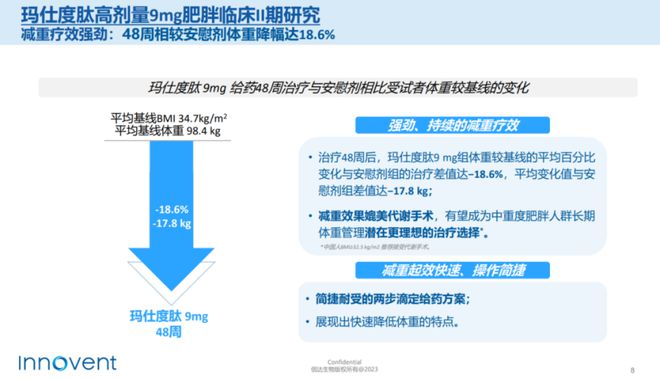
于2023年5月,IBI-362(玛仕度肽,GLP-1R/GCGR)高剂量组9mg的2期临床研究达到24周的首要终点,在中重度肥胖患者治疗中显示出可媲美减重手术的强劲疗效及良好的安全性。
10月30日信达生物宣布,将于2023年底启动玛仕度肽9mg在中国肥胖受试者中的III期临床研究。目前,GLP-1R/GCGR双重激动剂玛仕度肽在中国肥胖受试者中的II期临床研究已完成48周的治疗期。此项研究的主要目标已在24周时达成。
根据结果显示,9mg玛仕度肽组相较安慰剂组体重降幅达18.6%,高于24周的数据(-15.4%);体重下降超过15%或20%的受试者占比为51.2%和34.9%,相较于24周(31.7%和21.7%)显著增加。
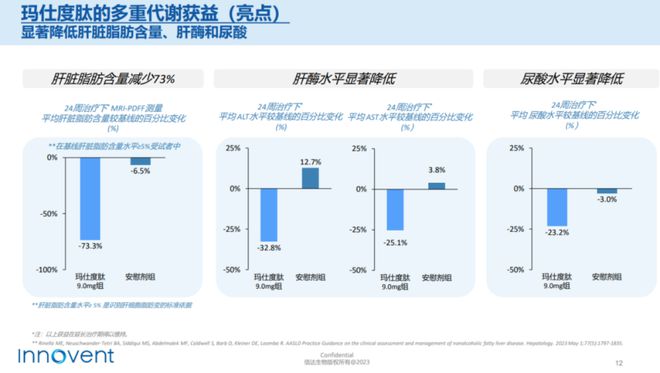
治疗24周后,玛仕度肽降低肝脏脂肪含量达73.3%,显著改善了一系列代谢指标(TG、TC、LDL-C、sUA),且该临床获益在48周继续维持。
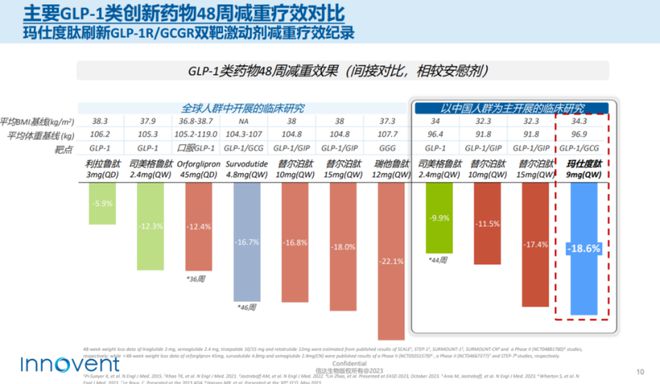
从与目前市面上的热门GLP-1靶点药物司美格鲁肽和替尔泊肽间接对比来看,48周减重效果玛仕度肽更优。
同时,玛仕度肽6mg治疗肥胖与T2DM的3期注册临床研究正在进行,计划于2023年底至2024年初提交治疗肥胖的首个NDA。
产品合作模式
通过对公司目前商业化产品分析,我们发现,信达目前药品可以做以下分类:
生物类似药:贝伐珠单抗、阿达木单抗、利妥昔单抗;
原研引进药:赛普替尼、佩米替尼、雷莫西尤单抗;
一类新药包括:信迪利单抗、奥雷巴替尼、伊基奥仑赛注射液、托莱西单抗。
而且,我们可以看到,信达的绝大多数商业化产品都是与其他公司合作完成,而绝大多数合作方都是礼来,从面上我们基本就能判断信达和礼来是有比较深的渊源的。
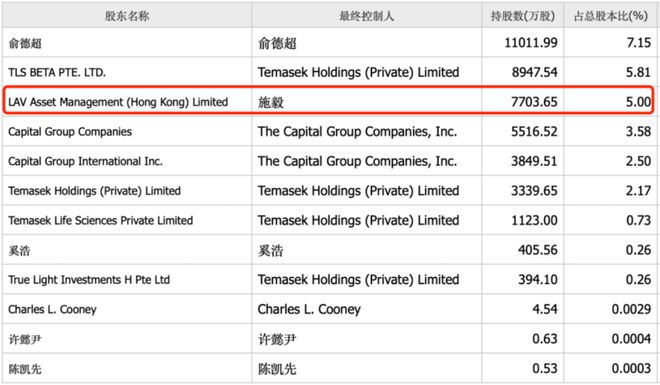
2008年礼来风险投资部门创立礼来亚洲基金(LAV),并于2011年正式独立运营,礼来持有LAV约10%的股权。同样在2011年信达生物成立,聚焦种子公司的LAV很快就在第二年参与了信达生物的B轮融资,并一路伴随信达生物成长,先后参与了后者后续的C轮和E轮融资。
目前LAV持有信达5%的股权。
但是,礼来与信达的合作并非因为旗下基金公司有持股,而是礼来认识到了信达的强大研发能力。
在2014年的时候,PD-1是当时的热门药物,K药与O药均已经上市,而礼来的PD-1管线却仍在研发中。按信达生物董事长俞德超的说法,礼来在对比信达的PD-1药物后,发现其有惊人的疗效,因此果断暂定了PD-1的自研项目,转而选择引进信达的PD-1管线。
正是基于对信达自研实力的认可,礼来才愿意引进信达的管线,也愿意将自身潜力管线的国内市场交给信达来开发。
其实这个模式和百济神州有点类似,只不过百济和安进的捆绑程度要更深,安进是百济的第一大股东,持股17.89%。
我看到有人会诟病信达这种合作模式是自研能力弱的体现,但我认为对于创新药企业来说,能够出药是第一位的,有药可卖是第一位的,生存下来是第一位的,与大药企深度合作其实有利于提高成药率,并且成为大药企一些药品的国内代理也有利于现金流的保障。
恒瑞之前基本是全自研模式,但是走到目前来看,效果也不是特别好,反而格局打开加强BD合作之后,公司的研发出现了一些积极变化。
这里的底层逻辑是,创新药是一个概率事件,你一个人摇色子摇出6的概率肯定不如两个人,所以,这种合作其实增加了成功了概率,而对于创新药来说,能成药是最大诉求,成药了两家甚至是三家分成,也好过研发成本直接打了水漂。
另外,从与礼来合作的经历我们也能看出,礼来与信达合作恰恰是看中其研发能力,所以,信达自研能力不强的论调可以说是不攻自破。
产品收入贡献
2023年上半年收入同比增加20.6%至27.0亿元,毛利同比增加24.3%至22.0亿元,股东净亏损同比缩小85.4%至1.4亿元。根据礼来中报,公司主要产品达伯舒上半年销售收入同比增加4%至1.6亿美元(约11.4亿人民币),其中二季度占约1.0亿美元(约7.3亿人民币),表明年初国内疫情消散后达伯舒销售收入快速增加。除达伯舒以外,公司另外八款产品销量也快速增加,上半年总销售收入同比增长约39.4%至约13.2亿元。
2023年第三季度产品销售收入同比大增45%以上至超16亿元,环比也显著增长,公司收入略超预期。根据礼来三季报,公司主要产品达伯舒三季度收入同比大增50%至1.15亿美元(约8.4亿人民币),其他产品三季度销售收入也同比增加40%以上,导致总收入超预期。
我们从公司的业绩能够看出当前的信达的收入状况如下:
1)目前公司的核心产品是达伯舒,销售收入三季度达到50%左右的占比;
2)达伯舒的增长经历了一个放缓后再提速的过程,从上半年的增长4%到三季度的增长50%,我们认为影响可能来自两方面,一方面是达伯舒大癌种胃癌适应症获批并纳入医保,另一方面是医疗反腐,对于疗效明确,数据优秀的创新药是一种提振;
3)刨除达伯舒,其他产品增速大概在40%左右的水平,增长势头也非常强劲,且多款药品都是近一两年获批,对于信达的营收增长贡献也将具有较好的持续性。
以上,我们对信达的整个业务基本面有了一个比较全面了解,下面做一个总结:
1)信达目前肿瘤领域有8款商业化产品,非肿瘤领域有2款商业化产品,自2022年以来公司共有4款新产品获批上市,加上已获批适应症的拓展,保证了公司营收较高的增长水平;
2)目前,公司的核心产品达伯舒销售占比在50%左右,并且通过适应症拓展重新回归高速增长水平,公司其他产品目前整体增速在40%左右,依托于近两年持续有新产品上市,以及适应症的拓展,我们认为公司的成长性能够有较好的延续;
3)公司与礼来有较深的合作关系,并且公司多款产品均为合作模式,我们认为这对信达来说并非坏事,通过合作提升了公司成药率,并且能够带来稳定的现金流,是Biotech能够成长为BioPharma的关键,而且从目前来看,BD能力的强的公司在发展上更具优势,此外,礼来与信达的深度合作其实也是看重其研发能力,所以,我们认为信达这种合作加自研的模式是兼顾安全性和成长性的,是一种独特优势,而非负面因素。
4)目前从信达的管线来说,最被寄予厚望的就是减肥药玛仕度肽,这个药现在已经被诺华和礼来打响了知名度,玛仕度肽与利拉鲁肽、替尔泊肽对比在临床数据具有一定优势,且GLP-1这个靶点可拓展适应症非常丰富,信达如果能够把握住减肥药的机会是非常有希望上一个大台阶的。
02财务分析
biotech的财务分析相对简单一些,我们将针对biotech的财务特性做专门的分析。
营收利润状况
公司营收在2020年出现了一个大幅增长的状况,这是信达PD-1产品舒泊达纳入医保后带来的快速放量,但是我们看2020至2022年,信达的营收增长放慢了,一方面是PD-1竞争比较激烈,一方面是医保谈判持续降价的影响。
而到了今年,我们看到信达生物的成长性在逐步回归,一方面是舒泊达持续新增大适应症癌种,目前已经覆盖5大癌种,相比最初纳入医保时的3种增长显著,另一方面,信达其他合作产品也进入了出药放量阶段,共同助推信达今年前两季度增速回归20%水平,三季度增速重回40%的较高水平。
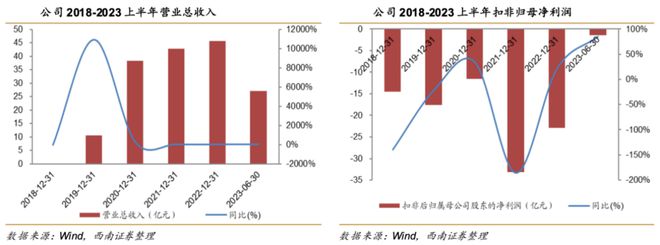
我们看到,今年信达增速回归之后,公司亏损幅度大幅下降,上半年扣非归母净利润-1.4亿元,亏损同比收窄85%,距离扭亏仅一步之遥。
毛利费用水平
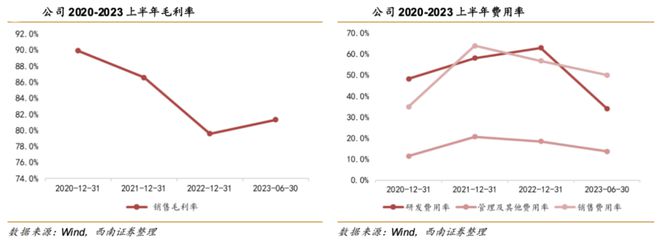
在公司增速回归之后,信达毛利率也出现了反弹。
费率方面,销售费率持续下降,一方面我们认为是公司产品销售规模化提升所致,另一方面,随着反腐的加强,疗效明确的创新药销售费率还有进一步下降的空间。
研发费率今年下降明显,主要是产品进入出药阶段,三期临床减少所致。
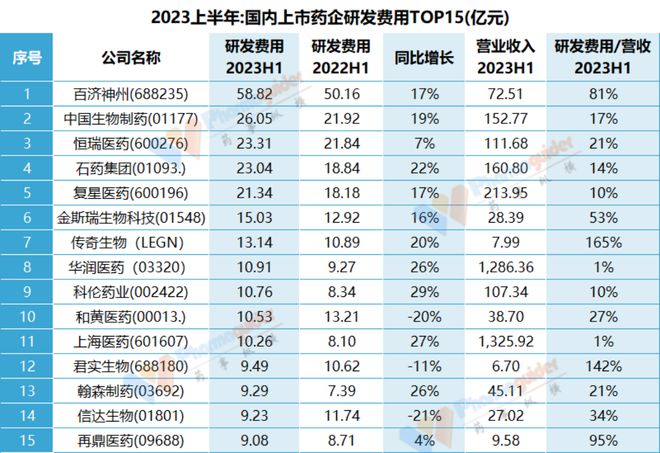
目前信达的研发费用投入大概排在国内14名的水平,相比去年有所下滑,这个研发投入单看biotech的话基本上是国内第一梯队。
目前信达账面上的流动资金大概120亿,每年研发费用按30亿保守估计,大概能够覆盖未来4年的研发投入,一般来说biotech大概就是覆盖未来3年的水平基本就是一个相对安全的状态,现在信达的产品已经能够贡献一定现金流,整体安全性还是非常高的。
总结一下:
1)目前信达依托适应症的拓张和新产品的陆续上市,营收再度重回高增长水平;
2)2023上半年信达亏损收窄至1.4亿,随着产品的持续较高增长,扭亏时点渐近;
3)信达目前研发费用投入保持在国内biotech第一梯队的水平;
4)目前信达流动性资金能够支撑公司未来4年的研发投入,加上目前信达已经有较为充足的产品贡献现金流,信达的整体财务安全度还是非常高的。
03其他要点
最新临床进展
在我们写分析文章的过程中,信达的研发进度就跟开挂了一样,持续受到临床管线的最新进展,我们一一过一下:
奥雷巴替尼片(耐立克)
2023年11月17日,奥雷巴替尼片正式获NMPA批准,用于治疗对一代和二代酪氨酸激酶抑制剂(“TKI”)耐药和╱或不耐受的慢性髓细胞白血病慢性期(“CML-CP”)成年患者。此次获批也是该药物继2021年首次获批、成功纳入2022版国家医保药品目录后的又一重要进展,将进一步加速惠及更广泛的中国慢性髓细胞白血病(“CML”)患者。
耐立克此次在目标适应症中获得完全批准,是基于一项开放、全国多中心、随机对照的关键性注册2期临床研究(HQP1351CC203)的结果。该研究旨在评估耐立克在一代和二代TKIs耐药和╱或不耐受的CML-CP患者中的有效性与安全性,患者被随机分配到耐立克®治疗组和现有最佳治疗(“BestAvailableTreatment,BAT”)对照组。临床数据显示,与对照的BAT相比,耐立克®治疗组的无事件生存期(EFS)显示出统计学上显著意义的改善,达到了该研究的主要终点。
泰萊替尼
2023年11月17日,NMPA已经正式受理下一代ROS1酪氨酸激酶抑制剂(“TKI”)泰莱替尼(他雷替尼)的新药上市许可申请(“NDA”),用于经ROS1-TKI治疗失败的ROS1阳性局部晚期或转移性非小细胞肺癌(“NSCLC”)成人患者的治疗。
此次NDA获受理是基于一项临床II期研究TRUST-I (NCT04395677)的积极结果。该试验是一项在中国开展的多中心、开放标籤、单臂试验,旨在评估泰莱替尼在中国ROS1阳性NSCLC患者中的的安全性、耐受性和疗效。TRUST-I临床研究的期中分析结果此前在2023年欧洲肺癌大会(ELCC)上公布。
泰莱替尼是一种口服、强效、脑渗透、选择性、新一代潜在最佳的ROS1抑制剂,正在评估用于ROS1阳性NSCLC的治疗。
泰莱替尼正在两项 2 期试验中评估在 ROS1 阳性 NSCLC 患者中的作用,分别是在中国开展的试验TRUST-I (NCT04395677)和全球关键试验TRUST-II(NCT04919811)。TRUST-I的积极中期结果于2023年欧洲肺癌大会(ELCC)上公布,TRUST-II的积极中期结果于2023年欧洲肿瘤内科学会大会(ESMO)上公布。
泰莱替尼于2022年被CDE授予突破性疗法认定(BTD),用于治疗既往经ROS1 TKI治疗的ROS1阳性晚期或转移性NSCLC成人患者以及未经ROS1 TKI治疗的ROS1阳性晚期或转移性NSCLC成人患者。除此之外,泰莱替尼还获得美国食品药品监督管理局(FDA)授予的用于治疗ROS1阳性NSCLC的突破性疗法认定(BTD)。
2021年6月,本公司与葆元医药签订了独家许可协议,在大中华区(包括中国大陆、香港、澳门和台湾)共同开发和商业化泰莱替尼。
IBI-351
2023年11月24日,公司公告,国家药监局已受理公司KRASG12C抑制剂IBI-351的新药上市申请(NDA)并纳入优先审评;适应症为二线治疗KRASG12C突变的晚期非小细胞肺癌(NSCLC)患者。
(1)KRAS,为近年来新突破的肿瘤靶点,近90%胰腺癌、30-40%结肠癌、15-20%的肺癌患者体内均出现KRAS基因突变,其突变发生率大于ALK、RET、TRK基因突变总和。其中KRASG12C,约占所有KRAS突变的44%。(2)该靶点药物,美国已批准Amgen和Mirati公司的Sotorasib(2022年销售2.85亿美元)和Adagrasib(2023年上半年销售1970万美元),中国尚无获批。(3)国内相关药企为加科思、益方生物以及再鼎医药等。加科思的JAB-21822和益方生物Garsorasib皆处于关键临床,再鼎医药从Mirati引进的Adagrasib国内处于临床Ⅲ期。益方与中国生物制药于2023年8月达成合作开发协议。
最新交流纪要要点
Q:公司的PD1相较同行放量速度快,原因是什么?
A:前三季度超过15e人民币的收入,君实是6.8亿人民币,百济神州是接近1亿美金。另外我们进医保以后价格低,友商通过赠药,实际价格比我们高。恒瑞没有公布过实际的单独销售额,听到的可能是终端销售数据,与出厂有些差别。恒瑞通过赠药,单支销售额也是我们的四倍。我们有希望今年PD1的销售量或是病人数量成为份额是最大的一家。做的不错的原因,首先是我们药的quality好,进医保也是一种背书;肝癌是全球第一个撞线的combo试验。公司对PD1的战略认知度高,今年年中就覆盖1500家医院,销售人员数量也在增长。渠道下沉,也承接了一些低线城市的患者。
Q:公司的国际化,具体的一些步骤和工作情况
A:信达目前在国际方面有一些积累,希望想的更远,看的更远。公司内部每年会开战略会,确定的两个战略,其一是做truly innovation,做global FIC;第二个就是做商业的国际化,全球化。在国外已经开始设立子公司,但人员目前还较少。国际化两步走,第一步先license out biosimilar、PD1的海外权益;在这个过程中逐渐学习。第二部是逐步建立自己comprehensive的团队,有一些品种在中美同步开展临床,比如CD47, PDL1-CD47 ,Tight,有了品种以后会考虑建立自己的网络,在未来的5-10年后,信达将有自己的海外网络。
Q:信达在海外的规模
A:欧洲、美国的分公司大概10-20个人的规模。在海外既有自己的队伍,也用了CRO做临床。用国内不同,临床队伍不多。在刘博士加入后,我们后面会在国外做研发,能更好的在国际上发展,能有有国际权益的产品上市。
Q:我们做海外的话,在临床研发等方面是不是最早的做法和国内就不一样?
A:国际化不是改变策略,只是我们现有研发的扩展和延伸。我们现在的在研产品,也是有有全球权益的,管线里面很多产品是有国际销售权益的。在开展临床上,在刘博士加入前,我们就已经在做这方面的发展,包括和罗氏引进的产品。刘博士加入后,将继续往这个方向发展。做国际化的公司,第一步是学走路,就是有产品。在现有的管线上,进一步发展FIC,做有患者需求的产品。今年两个产品,贝伐珠类似物和PD1 license out了。
Q:请问贝伐珠类似物的销售情况?产能情况?
A:我们估计还需要一年多看到FDA的结果。Coherus是美国做biosimilar很有经验的一家公司。我们认为在美国还是有一定的市场。中国方面,今年下半年获批,我们第一要做的是进医保,然后用达伯舒的销售队伍销售,因为原研药还没有下沉。达伯舒我们还是很有信心,国内可以领先,同时把海外权益卖给礼来后,可以把总体利益扩大两三倍。这是其他PD1 玩家没有的,两三年内可以实现国际销售。我们的产能很有优势,达伯舒已经转到不锈钢的6个3000L。两个biosimilar转到6个3000L后,会进一步加强产能优势。我们现在正在建造12个3000L,明年年底投产,一共会有6万L的产能。
Q:罗氏为什么给我们开放了双抗技术?
A:跟罗氏总部谈的。有些研发的管理层是从罗氏过来的,非常熟悉我们。这种合作和国际大公司之间也是比较常见的,但在中国我们是第一家做的。罗氏自己在投资者交流时回答为什么选我们,第一是希望通过和第三方的合作增加产出的可能性;第二是对信达的认可,认为信达执行力高。
Q:市场上很多人认为信达在将从biotech发展成为biopharma,公司怎么看?
A:有雄心,但是不是那么容易。国际上有一部分是成为pharma,有些biotech就是卖给pharma。信达从建立的时候,就要成为pharma,所以从一开始建立了一系列的体系。2018年开始建立销售的架构,建立了销售队伍的管理层。发展离不开投资者的support,所有想法一直跟投资者建立了很好的沟通。我们希望给投资者最大化的回报。
04逻辑梳理&投资策略
以上,我们对公司的产品、管线、发展状态以及财务状况有了一个相对全面的了解,下面做一个总结:
公司层面:
1)信达目前肿瘤领域有8款商业化产品,非肿瘤领域有2款商业化产品,自2022年以来公司共有4款新产品获批上市,加上已获批适应症的拓展,保证了公司营收较高的增长水平;
2)目前,公司的核心产品达伯舒销售占比在50%左右,并且通过适应症拓展重新回归高速增长水平,公司其他产品目前整体增速在40%左右,依托于近两年持续有新产品上市,以及适应症的拓展,我们认为公司的成长性能够有较好的延续;
3)公司与礼来有较深的合作关系,并且公司多款产品均为合作模式,我们认为这对信达来说并非坏事,通过合作提升了公司成药率,并且能够带来稳定的现金流,是Biotech能够成长为BioPharma的关键,而且从目前来看,BD能力的强的公司在发展上更具优势,此外,礼来与信达的深度合作其实也是看重其研发能力,所以,我们认为信达这种合作加自研的模式是兼顾安全性和成长性的,是一种独特优势,而非负面因素;
4)目前从信达的管线来说,最被寄予厚望的就是减肥药玛仕度肽,这个药现在已经被诺华和礼来打响了知名度,玛仕度肽与利拉鲁肽、替尔泊肽对比在临床数据具有一定优势,且GLP-1这个靶点可拓展适应症非常丰富,信达如果能够把握住减肥药的机会是非常有希望上一个大台阶的;
5)目前信达依托适应症的拓张和新产品的陆续上市,营收再度重回高增长水平;
6)2023上半年信达亏损收窄至1.4亿,随着产品的持续较高增长,扭亏时点渐近;
7)信达目前研发费用投入保持在国内biotech第一梯队的水平;
8)目前信达流动性资金能够支撑公司未来4年的研发投入,加上目前信达已经有较为充足的产品贡献现金流,信达的整体财务安全度还是非常高的;
9)近期公司公告了多款产品的临床进度,目前公司多款产品处于申报上市以及三期临床阶段,为公司后续的增长打下基础;
10)公司基于产品合作的模式,对于打开全球化布局打下了基础,目前国内创新药处于一个出海爆发前夜的阶段,具备海外布局优势的公司将更具竞争力。
总体看下来,我们认为,信达基于其强大的研发能力,以及较为广泛的合作模式,形成了较为独特的竞争优势,主要包括:
第一,提升了产品的成药率以及研发效率,从而实现了较快较好的产品卡位效果,提升了整体的竞争水平;
第二,成药率和研发效率的提升,为公司带来了良好的现金流水平,让公司能够快速度过biotech阶段,像BioPharma进化;
第三,广发的合作模式,让公司的国际化视野以及国际化能力更为出众,在国内创新药出海爆发的前夜,其价值尤为珍贵。
长期跟着我思路做创新药投资的朋友应该知道,我目前对于创新药的成长性和安全性考量是把安全性放在第一位的,安全性或者说确定性决定了你的仓位,通过对信达的研究,我们认为,一个是从定性的角度,一个是从安全性的角度,我们认为是一家相对不错创新药公司。
下面就进入到估值阶段。
估值层面:
对于尚未盈利的biotech公司,我们一般用PS来估值,我们以可比同类型biotech公司做一个对比,百济、君实、荣昌三家公司以2024年营收计算,平均PS为12倍。
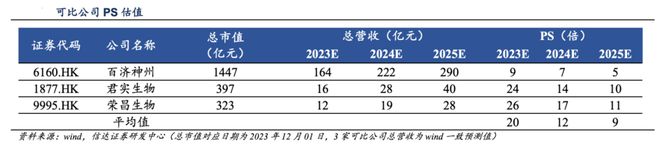
我们认为信达生物目前处于一个产品加速放量的阶段,所以我们可以给予相对高一些的估值水平,假设信达生物合理估值水平为13倍PS,那么,我们通过±3倍PS对应保守和乐观估值水平。
从而我们得到如下估值表:
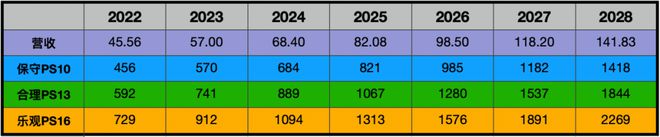
目前信达生物的市值为711亿港元,按1人民币≈1.0945港元换算,目前信达市值为650亿人民币,处于保守与合理估值区间,更接近与保守估值水平。
基于我们对信达目前基本面的分析,信达处于一个密集出药的阶段,将带动营收实现较为强劲的增长,所以,我们认为公司估值再度下探的空间不会太大,所以,现阶段如果要布局那就应该逐步逢低介入。
如开篇所言,我们的研究确实晚了一些,如果更早研究,我们拿到的价格也会更低,但目前估值水平更处于可以挥杆的阶段,也算是意外之喜。
最后我们回答前文的三个问题:
1)对信达的核心管线情况做一个全面的了解;
答:信达目前商业化产品主要以合作产品为主,癌症是主战场,非癌症领域新获批的托莱西单抗有望提供新的增长点,目前公司多款产品处于三期临床或者上市申请阶段,公司双靶点减肥产品目前临床数据优秀,有望成为公司下一个大单品。
2)信达的比较竞争优势在哪,能否持续?
答:信达的竞争优势在于,基于其强大的研发能力,获取到一系列的药物合作资源,为公司的成药率、研发效率以及出海能力打下基础,从而获取到了更好的确定性和成长性,这个竞争优势是其他biotech不具备的。
3)目前信达是否适合投资,投资策略是怎样的?
答:我们认为信达目前的市值水平不算特别贵,且公司处于一个营收爆发前夜,估值水平再度下行空间不大,所以,现在逢低介入是比较合理的操作策略。
以上就是我们对信达生物做的一个深度探讨,希望能够对您的投资有帮助。
Ps:本文仅作日常逻辑训练分析案例,不作为任何买卖依据,也不给任何买卖建议,请大家独立思考,股市有风险,入市需谨慎!
财经号声明: 本文由入驻中金在线财经号平台的作者撰写,观点仅代表作者本人,不代表中金在线立场。仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。同时提醒网友提高风险意识,请勿私下汇款给自媒体作者,避免造成金钱损失,风险自负。如有文章和图片作品版权及其他问题,请联系本站。



